10月22日,上海科技大学免疫化学研究所抗结核结构研究中心饶子和/杨海涛团队与中国科学院上海有机化学研究所马大为团队在学术期刊Protein & Cell上在线发表了题为“Crystal structure of SARS-CoV-2 main protease in complex with protease inhibitor PF-07321332”的合作研究论文。该研究论文报道了辉瑞(Pfizer)公司抗新冠临床靶向药物PF-07321332与病毒主蛋白酶1.6 Å高分辨率的晶体结构,并揭示了其抑制病毒靶点的精确分子机制。
自 2019 年 12 月以来,COVID-19大流行对全球人类健康造成了严重威胁。尽管在全球针对这一流行病的共同抗击下,许多针对SARS-CoV-2 的疫苗得以快速部署。然而,病毒突变株的出现显著降低了疫苗的有效性。因此,开发有效的抗病毒药物对于遏制 COVID-19 的传播和降低病死率至关重要。
新冠病毒在入侵细胞后,会首先合成自身复制必需的两条超长复制酶多肽(pp1a和pp1ab)。这两条超长多肽经过主蛋白酶(Mpro)和木瓜蛋白酶的精确剪切后才能组装成转录复制复合体,以进一步启动病毒的复制。更为重要的是,Mpro的氨基酸序列和三维结构在整个冠状病毒亚科以及SARS-CoV-2的不同突变株中具有极高的保守性,其因此成为当前广谱抗病毒药物开发的一个理想靶标。2020年初,免化所饶子和/杨海涛团队就与国内多家单位联合攻关,率先在国际上成功解析新冠病毒主蛋白酶的高分辨率三维空间结构,并筛选到数个有效抑制剂,相关成果先后发表于Nature和Nature Structural & Molecular Biology等杂志。目前研究团队发现的抗病毒小分子中已有2个抑制剂被美国FDA批准进入临床II期试验。
辉瑞公司近期推出的PF-07321332也是一个靶向新冠病毒主蛋白酶抑制剂,可以通过口服给药。由PF-07321332和抗HIV药物利托那韦组成的联合制剂Paxlovid已经通过I期临床试验,并同时开展II/III期临床试验。近日,辉瑞公司公布了该新药最新的中期临床数据分析,结果显示该口服药对具有发展成重症风险的新冠成年患者,可以降低其89%的住院率或病死率。
联合攻关团队解析了新冠病毒主蛋白酶和PF-07321332的高分辨率复合物结构(1.6 Å),精确阐释了抑制剂的作用机制。研究表明,该抑制剂的腈基能够与Mpro的关键催化残基Cys145共价结合,从而将主蛋白酶的活性中心“锁住”。特别需要关注的是,研究团队通过分析高分辨率的晶体结构发现,Mpro催化残基Cys145在结构中呈现双重构象:一部分和抑制剂结合,而另一部分呈游离状态,这也证实了PF-07321332是一种可逆共价抑制剂。该分子机制的阐明为新冠病毒药物开发提供了重要结构信息,为进一步设计抗新冠的特效药指明了方向。在该论文在Protein & Cell发表后,辉瑞公司针对PF-07321332的独立研究也于2021年10月28日被Science接受,并于2021年11月2日迅速在线发表。
免化所抗结核结构研究中心长期致力于新发、再发传染性疾病病原体的结构生物学研究及新药开发,这是该中心在新冠攻关的又一重要研究成果。上海科技大学免化所副研究员赵耀、中国科学院上海有机化学研究所博士后方超、上海科技大学博士研究生张琦为本文的共同第一作者。免化所研究员杨海涛,免化所特聘教授、清华大学教授饶子和院士,中国科学院上海有机化学研究所马大为院士为本文的共同通讯作者。上海科技大学为第一完成单位。同时,免化所副研究员杨秀娜、美国克利夫兰诊所杨楷林也参与了此项研究。该研究得到了科技部重点研发计划和国家自然科学基金的大力支持。
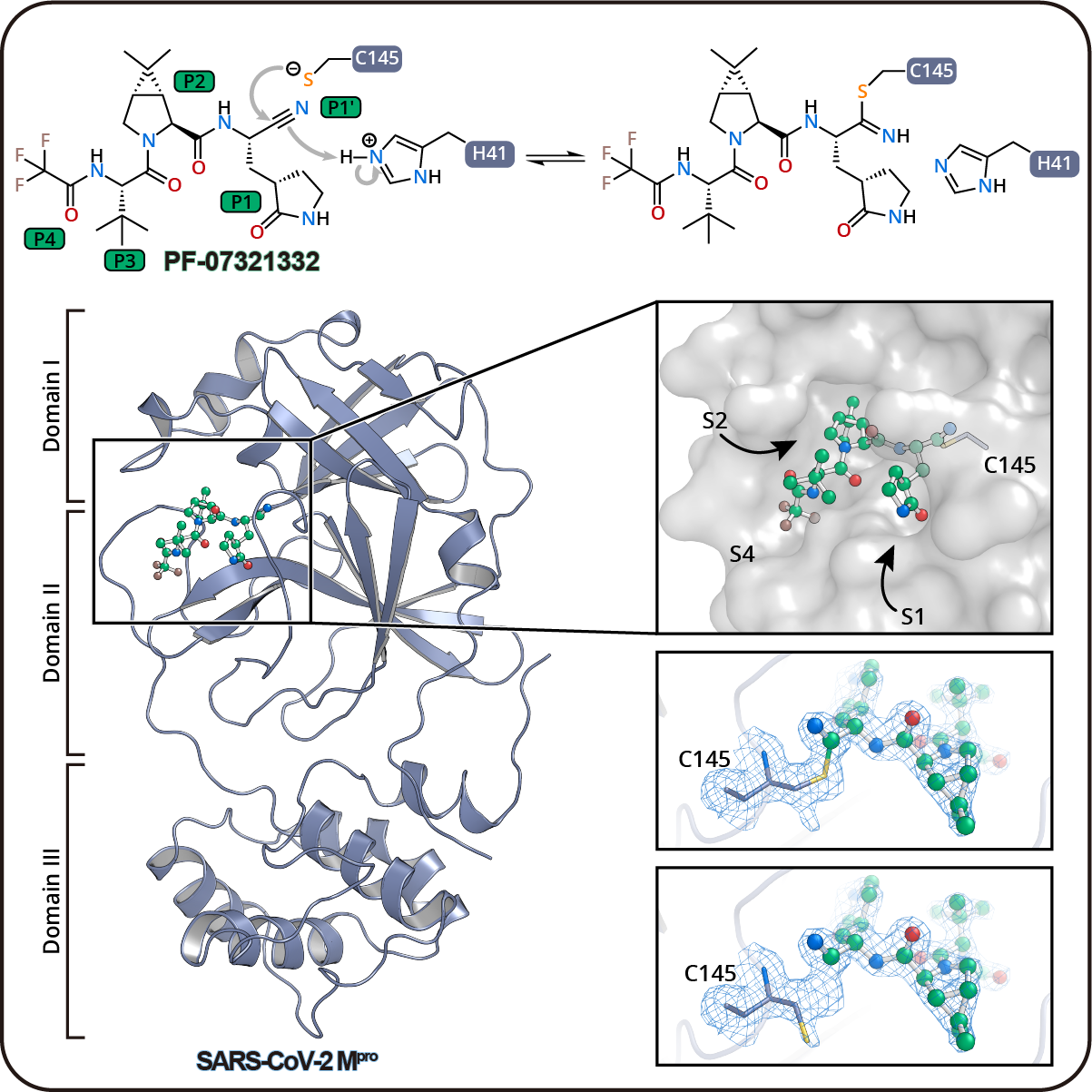
新冠病毒主蛋白酶与抑制剂PF-07321332的复合物结构
文章链接:https://pubmed.ncbi.nlm.nih.gov/34687004/

