9月2日,我校物质学院季泉江课题组在《自然·化学生物学》 (Nature Chemical Biology)杂志发表题为“Programmed genome editing by a miniature CRISPR-Cas12f nuclease”的研究论文,揭示了极小型CRISPR核酸酶—AsCas12f1(仅422个氨基酸)的DNA识别和切割机制,并将其转化为一种新型基因编辑工具,成功实现了在细菌和哺乳动物细胞中的基因编辑。此研究进一步拓展了CRISPR核酸酶工具库,为开发微型精准基因编辑和治疗工具提供了新思路。

CRISPR/Cas基因编辑技术由于其简便性和高效性,已被广泛应用于生物学、医学、农学等领域的基础与应用研究。目前广泛使用的Cas9与Cas12a核酸酶均具有较大的分子尺寸(通常大于1000个氨基酸),而广泛应用于基因治疗中的腺相关病毒载体的承载容量却十分有限,在容纳CRISPR核酸酶与引导RNA的编码序列之余往往难以承载更多其他功能元件,这严重限制了其在基因治疗等领域的应用。因此,亟需发掘更小分子尺寸的CRISPR核酸酶以解决这一难题。
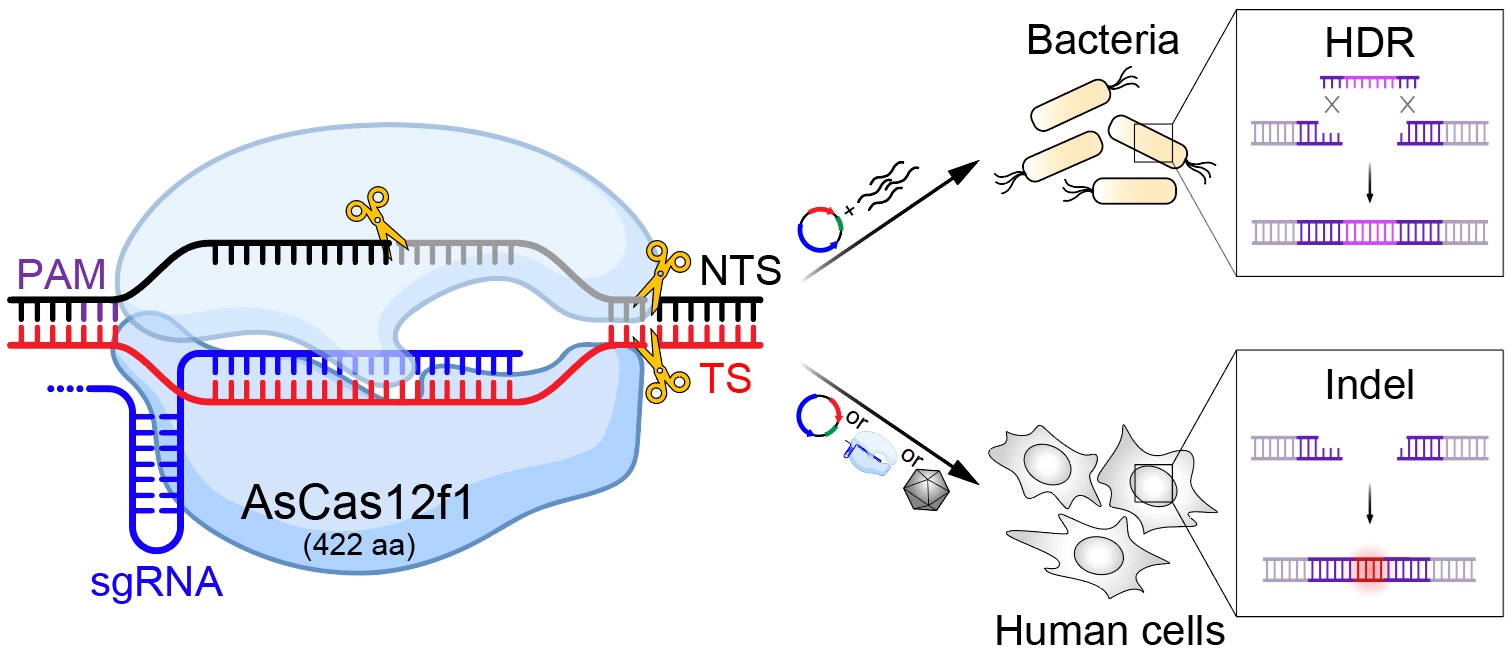
Cas12f核酸酶是V-F型CRISPR/Cas系统的效应因子,通常具有较小的分子尺寸(约400-700个氨基酸)。在本研究中,研究人员系统研究了来自细菌Acidibacillus sulfuroxidans中的AsCas12f1核酸酶的生化性质与DNA切割机制,发现该核酸酶特异性识别PAM序列5’-TTR(R代表A或G),并在crRNA和tracrRNA形成的二元复合体引导下,实现对DNA的靶向切割,产生带有不对称粘性末端的双链DNA断裂。研究人员分别向大肠杆菌和肺炎克雷伯氏菌中引入AsCas12f1和Lambda Red重组酶系统以及单链修复模板,实现了在这两种细菌中的精确基因编辑。而后研究人员又将AsCas12f1分别通过质粒、核糖核蛋白复合体(RNP)以及腺相关病毒(AAV)等方式导入哺乳动物细胞中,并成功在靶位点引入了缺失或插入突变(Indel)。
AsCas12f1仅有422个氨基酸,是目前已知分子尺寸最小,且在哺乳动物细胞中具有基因编辑能力的CRISPR核酸酶。它的发现与鉴定为今后开发新型基因治疗工具提供了新的可能性。
上海科技大学为该项工作的第一完成单位,季泉江课题组助理研究员吴兆韡为第一作者,季泉江教授为通讯作者。上海科技大学生命学院分子细胞平台为该研究提供了技术支持。该研究得到了国家自然科学基金委、科技部、上海市科委、上海科技大学启动经费、广州实验室应急攻关项目和中国博士后科学基金等项目的支持。

